VALENCIA
HISTORIA
La etimología de la palabra "valencia" proviene de 1543, significando "molde", del latín valentia "fuerza, capacidad", y el significado químico refiriéndose al "poder combinante de un elemento" está registrado desde 1884, del alemán Valenz. En 1890, William Higgins publicó bocetos sobre lo que él llamó combinaciones de partículas "últimas", que esbozaban el concepto de enlaces de valencia.1 Si, por ejemplo, de acuerdo a Higgins, la fuerza entre la partícula última de oxígeno y la partícula última de nitrógeno era 6, luego la fuerza del enlace debería ser dividida acordemente, y de modo similar para las otras combinaciones de partículas últimas: estas son las de la tabla periódica.
Sin embargo, la incepción no exacta de la teoría de las valencias químicas puede ser rastreada a una publicación de Edward Frankland, en la que combinó las viejas teorías de los radicales libres y "teoría de tipos" con conceptos sobre afinidad química para mostrar que ciertos elementos tienen la tendencia a combinarse con otros elementos para formar compuestos conteniendo 3 equivalentes del átomo unido, por ejemplo, en los grupos de tres átomos (vg. NO3, NH3, NI3, etc.) o 5, por ejemplo en los grupos de cinco átomos (vg. N2O5, NH4O, P2O5, etc.) Es en este modo, según Franklin, que sus afinidades están mejor satisfechas. Siguiendo estos ejemplos y postulados, Franklin declaró cuán obvio esto es que:
Una tendencia o ley prevalece (aquí), y que, no importa qué puedan ser los caracteres de los átomos que se unen, el poder combinante de los elementos atrayentes, si me puedo permitir el término, se satisface siempre por el mismo número de estos átomos.
TABLA DE VALENCIA
ESTADOS DE OXIDACION
| Elemento | Estados negativos de oxidación | Cero | Estados positivos de oxidación | Notas | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| −4 | −3 | −2 | −1 | 0 | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||
| Hidrógeno | −1 | H | +1 | ||||||||||||
| Helio | He | ||||||||||||||
| Litio | Li | +1 | |||||||||||||
| Berilio | Be | +1 | +2 | 1 | |||||||||||
| Boro | B | +1 | +2 | +3 | |||||||||||
| carbono | −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | ||||||
| nitrógeno | −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | ||||||
| Oxígeno | −2 | −1 | O | +1 | +2 | ||||||||||
| Flúor | −1 | F | |||||||||||||
| Neón | Ne | ||||||||||||||
| Sodio | −1 | Na | +1 | ||||||||||||
| Magnesio | Mg | +1 | +2 | 2 | |||||||||||
| aluminio | Al | +1 | +3 | ||||||||||||
| silicio | −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | ||||||
| Fósforo | −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | ||||||
| Azufre | −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Cloro | −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||||
| Argón | Ar | ||||||||||||||
| Potasio | −1 | K | +1 | ||||||||||||
| Calcio | Ca | +1 | +2 | 3 | |||||||||||
| Escandio | Sc | +1 | +2 | +3 | |||||||||||
| titanio | −1 | Ti | +2 | +3 | +4 | ||||||||||
| Vanadio | −1 | V | +1 | +2 | +3 | +4 | +5 | ||||||||
| Cromo | −2 | −1 | Cr | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Manganeso | −3 | −2 | −1 | Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||
| Hierro | −2 | −1 | Fe | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 4 5 | |||
| Cobalto | −1 | Co | +1 | +2 | +3 | +4 | +5 | ||||||||
| Níquel | −1 | Ni | +1 | +2 | +3 | +4 | |||||||||
| Cobre | Cu | +1 | +2 | +3 | +4 | ||||||||||
| zinc | Zn | +1 | +2 | 6 | |||||||||||
| Galio | Ga | +1 | +2 | +3 | |||||||||||
| Germanio | −4 | Ge | +1 | +2 | +3 | +4 | |||||||||
| Arsénico | −3 | As | +2 | +3 | +5 | ||||||||||
| Selenio | −2 | Se | +1 | +2 | +4 | +6 | 7 | ||||||||
| Bromo | −1 | Br | +1 | +3 | +4 | +5 | +7 | ||||||||
| Krypton | Kr | +2 | |||||||||||||
| Rubidio | −1 | Rb | +1 | ||||||||||||
| Estroncio | Sr | +1 | +2 | 8 | |||||||||||
| Itrio | Y | +1 | +2 | +3 | 9 10 | ||||||||||
| zirconio | Zr | +1 | +2 | +3 | +4 | ||||||||||
| Niobio | −1 | Nb | +2 | +3 | +4 | +5 | |||||||||
| Molibdeno | −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Tecnecio | −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| Rutenio | −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||||
| Rodio | −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||||
| Paladio | Pd | +2 | +4 | ||||||||||||
| Plata | Ag | +1 | +2 | +3 | +4 | 11 | |||||||||
| Cadmio | Cd | +1 | +2 | 12 | |||||||||||
| Indio | In | +1 | +2 | +3 | |||||||||||
| Estaño | −4 | Sn | +2 | +4 | |||||||||||
| Antimonio | −3 | Sb | +3 | +5 | |||||||||||
| Telerio | −2 | Te | +2 | +4 | +5 | +6 | |||||||||
| Yodo | −1 | I | +1 | +3 | +5 | +7 | |||||||||
| xenon | Xe | +2 | +4 | +6 | +8 | ||||||||||
| Cesio | −1 | Cs | +1 | ||||||||||||
| Bario | Ba | +2 | |||||||||||||
| Lántano | La | +2 | +3 | ||||||||||||
| Cerio | Ce | +2 | +3 | +4 | |||||||||||
| praseodymium | Pr | +2 | +3 | +4 | |||||||||||
| Neodimio | Nd | +2 | +3 | ||||||||||||
| promethium | Pm | +3 | |||||||||||||
| samarium | Sm | +2 | +3 | ||||||||||||
| europium | Eu | +2 | +3 | ||||||||||||
| gadolinium | Gd | +1 | +2 | +3 | |||||||||||
| terbium | Tb | +1 | +3 | +4 | |||||||||||
| dysprosium | Dy | +2 | +3 | ||||||||||||
| holmium | Ho | +3 | |||||||||||||
| erbium | Er | +3 | |||||||||||||
| thulium | Tm | +2 | +3 | ||||||||||||
| ytterbium | Yb | +2 | +3 | ||||||||||||
| lutetium | Lu | +3 | |||||||||||||
| Hafnio | Hf | +2 | +3 | +4 | |||||||||||
| Tántalo | −1 | Ta | +2 | +3 | +4 | +5 | |||||||||
| Tungsteno | −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| Renio | −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| Osmio | −2 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||||
| Iridio | −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | 13 14 | |||
| Platino | Pt | +2 | +4 | +5 | +6 | ||||||||||
| Oro | −1 | Au | +1 | +2 | +3 | +5 | |||||||||
| mercurio | Hg | +1 | +2 | +4 | 15 | ||||||||||
| Talio | Tl | +1 | +3 | ||||||||||||
| Plomo | −4 | Pb | +2 | +4 | |||||||||||
| Bismuto | −3 | Bi | +3 | +5 | |||||||||||
| Polonio | −2 | Po | +2 | +4 | +6 | ||||||||||
| Astato | −1 | At | +1 | +3 | +5 | +7 | |||||||||
| Radón | Rn | +2 | +4 | +6 | 16 17 | ||||||||||
| Francio | Fr | +1 | |||||||||||||
| Radio (elemento) | Ra | +2 | |||||||||||||
| Actinio | Ac | +2 | +3 | 18 | |||||||||||
| Torio | Th | +2 | +3 | +4 | |||||||||||
| protactinium | Pa | +2 | +3 | +4 | +5 | 19 | |||||||||
| Uranio | U | +2 | +3 | +4 | +5 | +6 | 20 | ||||||||
| Neptunio | Np | +3 | +4 | +5 | +6 | +7 | |||||||||
| Plutonio | Pu | +3 | +4 | +5 | +6 | +7 | +8 | 21 | |||||||
| Americio | Am | +2 | +3 | +4 | +5 | +6 | |||||||||
| curium | Cm | +3 | +4 | ||||||||||||
| berkelium | Bk | +3 | +4 | ||||||||||||
| californium | Cf | +2 | +3 | +4 | |||||||||||
| einsteinium | Es | +2 | +3 | ||||||||||||
| fermium | Fm | +2 | +3 | ||||||||||||
| mendelevium | Md | +2 | +3 | ||||||||||||
| nobelium | No | +2 | +3 | ||||||||||||
| lawrencium | Lr | +3 | |||||||||||||
| rutherfordium | Rf | +4 | |||||||||||||
| dubnium | Db | +5 | 22 | ||||||||||||
| seaborgium | Sg | +6 | 23 | ||||||||||||
| bohrium | Bh | +7 | 24 | ||||||||||||
| hassium | Hs | +8 | 25 | ||||||||||||
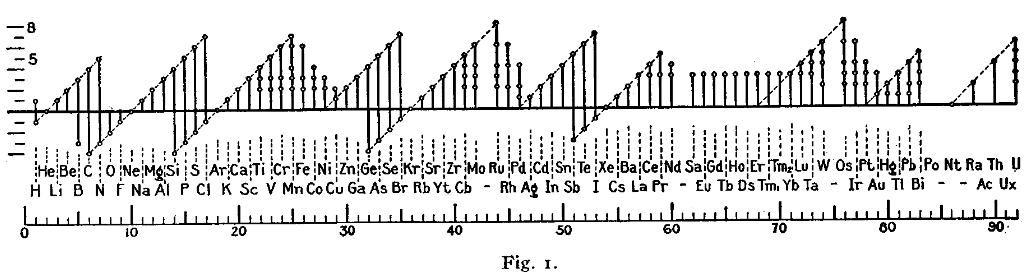
Una figura con un formato similar que la mostrada debajo fue usada por Irving Langmuir en 1919 para demostrar la regla del octeto.26 La periodicidad de los estados de oxidación fue uno de las claves que evidenciaban la regla de Langmuir.



No hay comentarios:
Publicar un comentario